|
Präparation einer Raubwanze |
Abkürzungsverzeichnis |
| Die Morphologie der Insekten lässt sich an einem Beispiel praktisch erarbeiten. Damit sollen zum einen die anatomischen Verhältnisse verdeutlicht werden, zum andern sollen auch Besonderheiten von Blutsaugern als spezifische Differenzierungen des sonst für diese Präparation üblichen, orthopteroiden Typs (Schabe, Heuschrecke) verstanden werden. |
|
| Als Objekt eignet sich besonders gut Dipetalogaster maxima, eine ungewöhnlich große Raubwanze (Reduviidae: Hemiptera), deren Imago 40 mm Länge erreicht. Diese Triatomine lebt in den Nebelwüsten der kalifornischen Halbinsel Baja california vor Mexiko. Sie ist tagaktiv und saugt an Eidechsen, lässt sich aber mit Mäuseblut mit dem üblichen Aufwand züchten. Rhodnius prolixus und Triatoma infestans, beide Vektoren der Chagaskrankheit werden etwa 20 mm lang und erfordern etwas mehr Übung im Präparieren kleiner Objekte. Die nachfolgende Beschreibung bezieht sich, wenn nichts anderes gesagt wird, auf Rhodnius prolixus (Fig. 1). |
|
|
Die Imagines sollten 1 bis 3 Wochen zuvor nicht mehr gefüttert worden sein. Sie werden mit Kohlensäuregas getötet oder bei -40°C in der Tiefkühltruhe. Tiefgefrohren können Sie auch aufbewahrt werden ohne innerlich zu erhärten. In Alkohol oder anderen Fixierungen werden die inneren Organe brüchig. Die Tiere werden zunächst trocken betrachtet; danach legen wir sie in eine physiologische Salzlösung, wenn vorhanden, in Ringerlösung für Insekten. In Alkohol konservierte Raubwanzen überführen wir in Glyzerin-Alkohol 1:3. Reines Glyzerin sollte bereit stehen; es eignet sich als provisorisches Einschlussmittel für wässerige Objekte bei einer anschließenden mikroskopischen Untersuchung. Außerdem bewegen sich darin kleinste Teilobjekte langsamer. |
|
|
Wir präparieren unter der binokularen Lupe mit Insektennadeln, deren Kopf abgekniffen wurde und entweder in einem Nadelhalter oder in ein Holzstäbchen gesteckt werden. Auch angeschliffene, feststehende chirurgische Nadeln leisten gute Dienste. Ferner benötigen wir ein spitzes, kleines Skalpell und eine spitz zugeschliffene Uhrmacherpinzette, sowie eine feine, leicht gebogene Schere. Zum Feststecken benützen wir Insektennadeln. Einigen davon brechen wir das Köpfchen ab, indem wir sie im breiten Winkel der Uhrmacherpinzette mehrfach abbiegen. Ein Abziehstein feinster Körnung ("Belgischer Brocken") dient zum Schleifen der Instrumente: Nadeln dreikantig, eine Insektennadel als Häkchen. Als Präparierschalen dienen eine mit farblosem, eine zweite mit schwarzem Paraffin ausgegossene Schale (4 x 4,5 cm). Für kleine Objekte eignet sich ein runder Kegel aus Paraffin (Ausguss eines Schmelztiegels mit etwa 6 cm Öffnung). In die Spitze des Kegels schaben wir eine flache Grube von etwa 10 mm Tiefe. So kann das Licht ungehindert einstrahlen. |
|
|
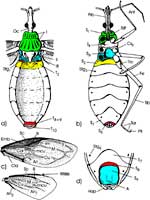
Äußere Gestalt (Abb. 1): Der langgestreckte Kopf trägt ein Paar kugelig vorgewölbter Komplexaugen und am Hinterrand dorsal zwei Ocellen, erkennbar an den klaren Cornealinsen. Die Dorsalfläche des Kopfes wird vom Hinterhaupt bis zu den Komplexaugen von der Frons eingenommen. Sie geht nach vorne ohne Naht in den Clypeus über. Er setzt sich in einen Anteclypeus fort. Jederseits von ihm sind die viergliedrigen Antennen jeweils auf einem kleinen Sockel eingelenkt. Der Anteclypeus trägt terminal das zweigliedrige Labrum, dessen Spitze bedeckt die Proboscis. Diese wird in der Ruhe ventrad eingeschlagen, wobei das langgestreckte Labium nach rückwärts über die Basis des Kopfes hinaus reicht. |
|
|
Thorax: Von dorsal betrachtet umschließt der im Umriss trapezförmige Prothorax das Hinterhaupt mit einem sklerotisierten Kragen. Das Pronotum endet caudad mit einem quer verlaufenden, kräftigen Wulst. Es lässt sich leicht anheben. Dabei wird das Scutum des Mesothorax sichtbar. An dessen Seiten sind die Vorderflügel eingelenkt. Das Mesonotum endet mit einem spitzen Dorn, dem Scutellum. Es überragt das schmale Postnotum des Metathorax, an dessen vorderen Ecken die häutigen Hinterflügel eingelenkt sind. Die an der Basis sklerotisierten Vorderflügel (Hemielytren) sind übereinander gefaltet (rechts über links), darunter die häutigen Hinterflügel (links über rechts). Beim Flug werden die Hinterflügel mittels einer bedornten Kante der Costa mit einem entsprechenden Connexivum der Vorderflügel verkoppelt (Abb. 1 c) und von diesen passiv mitbewegt. Neben den Flügeln ragt die laterale Kante des Abdomens hervor. Sie kann bei anderen Arten kontrastreich gemustert sein. |
|
|
In der Ansicht von lateral (Abb.2a) wird das vordere thorakale Stigma sichtbar, wenn man das darüber liegende Pronotum anhebt. Die Pleuren des zweiten und dritten Thorakalsegments sind wechselseitig ineinander verfalzt. Das caudale thorakale Stigma wird vom Mesonotum völlig verdeckt. Um es darzustellen, muss man die beiden Thorakalsegmente gewaltsam trennen. Inwendig entspringen zahlreiche Tracheenstämme, welche in die Beine, die thorakalen Muskeln und den Kopf ziehen. |
 Abb. 2a 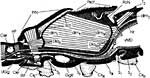 Abb. 2b |
|
Von ventral blickt man auf die thorakalen Sterna, von denen das Dritte stark gewölbt ist. An seiner caudalen Grenze beobachtet man eine tiefe Kerbe. In ihr verbirgt sich das erste abdominale Sternum. |
|
|
Die Gangbeine bestehen aus der proximalen Coxa, dem kurzen Trochanter, der mit dem kräftigen Femur verschmolzen ist. Es folgen die stark abgewinkelte, dünnere, lange Tibia und ein dreigliedriger Tarsus. Der Prätarsus trägt ein Paar Endklauen, denen zwei lange Borsten opponieren. Ein Pulvillus fehlt. |
|
|
Abdomen (Abb. 1): Nachdem die beiden Flügelpaare entfernt wurden, erkennen wir deutlicher die lateralen Teile des weniger stark sklerotisierten, schmalen Postnotum. Ihm folgt eine Reihe breiter, abdominaler Terga. Bei den Hemipteren ist das erste Abdominalsegment stark reduziert. Es ist lediglich an dem zugehörigen ersten abdominalen Stigma erkennbar, das sich jederseits auf einem winzigen Skleriten, den Resten des 1. Tergum öffnet. Das zugehörige 1. Sternum ist äußerlich nicht zu sehen. Das 2. bis 7. Tergum sind breit, das 8. bis 10. bedecken das spitze Ende des Abdomens. Von ventral beobachten wir die breiten Platten des 2. bis 7. Sternum. Auf ihnen öffnen sich beiderseits die abdominalen Stigmen 2 bis 7. |
|
|
Beim Männchen umschließt das 7. Sternum einen ovalen Komplex, der auf leichten Druck vorspringt und das 8. und 9. Sternum erscheinen lässt (Abb. 3 a, b). Das letztere trägt die äußeren Geschlechtsorgane: Ein Paar lange, gebogene Harpagonen und den in der Ruhe eingeschlagenen, zweigliedrigen Aedeagus unter dem flachen, röhrenförmigen 10. Segment, auf dessen Spitze der Anus liegt. Auch er ist in der Ruhe eingezogen. |
|
|
Beim Weibchen ist das 8. Sternum median tief eingekerbt; lateral artikuliert es beiderseits mit dem zugehörigen 8. Tergum (Abb. 3 c, d). Danach folgen drei Paar Loben, die Valvulae 1 bis 3, vergleichend-morphologisch Gonapophysen des 8. und 9. Segments. Sie bilden den Ovipositor und werden bei der Eiablage vorgestreckt. Zwischen den Valvulae 1 und 2 liegt die Geschlechtsöffnung dorsad des 8. Sternum. Die Valvulae 2 artikulieren mit je einem Valvifer am Tergum 9, zu dem auch die Valvulae 3 gehören. Terminal befindet sich der in der Ruhelage eingezogene Analkegel mit dem 11. Tergum. |
|
|
Mit dem Skalpell, bei D. maxima mit der Schere, schneiden wir am spitzen Hinterende des Abdomens beginnend die Membran zwischen den abdominalen Terga und Sterna durch und trennen schließlich die dorsale Bedeckung des Abdomens als Ganzes vom Metathorax ab. Dann stecken wir die Raubwanze fest und gießen Medium in die Präparierschale (Fig. 4). |
|
|
Innere Anatomie (Abb. 4 a): Auf der Innenseite der abdominalen Terga erkennen wir das median verlaufende Rückengefäß oder Herz, eingebettet in das lockere Gewebe des Fettkörpers. Wurde das Tier vor 1 bis 7 Tagen gefüttert, so fällt im verbliebenen ventralen Teil des Abdomens der voluminöse, vordere Abschnitt des Mitteldarmes auf. Er nimmt die frische Blutmahlzeit auf und wird deshalb auch als Magen bezeichnet. An seinem Eingang im Bereich der Cardia, leben symbiontische Actinomyceten (Nocardia spec., bei Rhodnius wurde Rhodnococcus rhodnii beschrieben); sie werden kontaminativ mit dem Kot auf die nächste Generation übertragen. Ohne Fütterung liegt der vordere Mitteldarm in Falten, beim Weibchen überdeckt von den Ovarien. Der schlanke Oesophagus verschwindet im Thorax, ebenso die paarigen langgestreckten Speicheldrüsen, von denen wir bis jetzt nur die distalen Enden zu seinen Seiten sehen (zu ihnen gesellt sich craniad noch ein weiteres Paar kleiner kugeliger Drüsen). Sobald wir den Magen etwas zur Seite geschoben oder angehoben haben, bekommen wir den langen, dünnen, hinteren Abschnitt des Mitteldarmes zu Gesicht. Er endet an der Stelle, wo die zahlreichen, perlschnurartigen Malpighi-Gefäße mit kleinen Ampullen ansetzen. Danach folgt das keulenförmig erweiterte Rectum (Rec) (Abb. 4 b). Die beim typischen Insekt vier Rectalpapillen bilden bei Rhodnius am Eingang des Rectum ein ziemlich geschlossenes, kleeblattähnliches Polster (nur mikroskopisch zu sehen). Das Ileum ragt zapfenförmig in die Rectalampulle hinein. Beim Weibchen wird das Abdomen zur Hauptsache von den beiden Ovarien mit jeweils 7 Eiröhren (Ovariolen) ausgefüllt. Diese sind telotrophisch, d.h. die Nährzellen liegen im Germarium und senden den Dotter über je einen dünnen Kanal zur wachsenden Eizelle. Auf jeder Seite reifen jeweils mehrere Eier gleichzeitig. Die beiden Oviducte vereinigen sich zum geräumigen Uterus, in den zwei kurze schlauchförmige Anhangsdrüsen münden. Das unpaare, ebenfalls schlauchförmige Receptaculum seminis endet mit einem langen, dünnen Kanal in das proximale Ende der Vagina. |
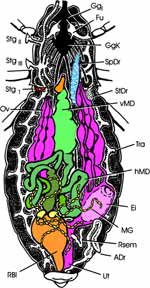 Abb. 4a 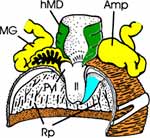 Abb. 4b 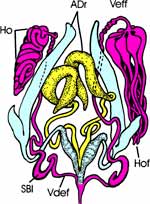 Abb. 4c |
| Die Männchen besitzen zwei Paar Anhangsdrüsen (Abb. 4 c). Ein Paar bildet jederseits einen langen und einen kürzeren, keulenförmigen Schlauch. Der gemeinsame Ausführgang erweitert sich terminal zu einer länglichen Blase. Das zweite Paar ist kleiner und erweitert sich etwa terminal ebenfalls. Beide Drüsenpaare münden in den Ductus ejaculatorius. Die paarigen Hoden liegen lateral im vorderen Drittel des Abdomens. Sie bestehen aus mehreren schlauchartigen Hodenfollikeln, die zunächst nach vorne ziehen, um sich im Bereich des 2. Abdominalsegments über kurze Vasa efferentia zu vereinigen. Der dünne, leicht gewundene Samenleiter zieht caudad entlang der Anhangsdrüsen und erweitert sich zu einer kurzen, schlauchförmigen Samenblase (Vesiculum seminalis, Vsem). Deren Ausführgang (Vas deferens) vereinigt sich mit dem der Gegenseite zum Ductus ejaculatorius. |
|
|
Jetzt wenden wir uns dem Inneren des Thorax zu (Abb. 4a). Das trapezförmige Pronotum überdeckt das Scutum des Mesothorax schildförmig. Wir klappen das Pronotum nach vorn und erkennen, dass der Prothorax dorsoventral beweglich auf dem Mesothorax aufsitzt. Wir können das Pronotum abtrennen, sollten aber das zugehörige Sternum mit dem 1. Beinpaar belassen. Die Muskulatur für das 1. Flügelpaar nimmt den größten Raum des Thorax ein. Das schmale Tergum des Metathorax wird vom Scutellum überdeckt und reicht als ein ebenfalls tief eingefaltetes hinteres, metathorakales Diaphragma ventrad. Zwischen beiden spannen sich die mesothorakalen Längsmuskeln der gut entwickelten indirekten Flugmuskulatur der Vorderflügel aus. Dies ist am besten auf einem Sagitalschnitt zu erkennen, den wir eigens mit einer Rasierklinge herstellen müssen (Abb. 2b). Ihre dorsoventral verlaufenden Antagonisten entspringen lateral auf dem Scutum und Scutellum, die zusammen das Mesonotum ausmachen. Die geringere Muskulatur der Hinterflügel liegt in lateralen Winkeln des Metathorax. |
|
|
Nachdem wir die Terga von Meso- und Metathorax abgetragen und die Flugmuskeln entfernt haben, erkennen wir lateral die zahlreichen Tracheenstämme, die in den Atria der beiden thorakalen Stigmen entspringen und den gesamten Thorax sowie den Kopf versorgen. |
|
|
Dazu präpariert man am besten ein frisch in CO2 getötetes Tier in physiologischer Salzlösung. Das Tracheensystem reflektiert Licht durch die eingeschlossene Luft bis in die feinsten Verästelungen. Man kann auch bereits fixierte Tiere kurz an der Luft trocknen und dann in Glyzerin bringen. |
|
|
In den lateralen Ecken des Metathorax findet sich je ein linsenförmiges, weißes Bläschen: Stinkdrüsen, die sich in die Einsenkung des Pleuralapodems dorsal der dritten Coxen nach außen öffnen (schwer zu sehen). Wir heben den Oesophagus und mit ihm den Darmtrakt heraus. |
|
|
Jetzt blicken wir auf zahlreiche, längsverlaufende Nervenstränge, denen wir craniad folgen (Abb. 4a). An der Vorderkante des Mesothorax liegt ein Ganglienkomplex, der vorn über ein Paar Konnektive mit einem kleineren, prothorakalen Ganglion verbunden ist. Es sendet je einen Nerven in das 1. Beinpaar. Vom folgenden Ganglienkomplex gehen caudad dicke Nervenstränge in das 2. und 3. Beinpaar, sowie ein weiteres dickes Nervenpaar in das Abdomen zur Muskulatur der äußeren Geschlechtsorgane. Zwischen den starken Nervensträngen treten weitere, feine Nervenpaare aus. Es handelt sich somit bei dem angesprochenen Komplex um die vereinigten Ganglien des 2. und 3. Thoraxsegmentes einschließlich aller folgenden Abdominalsegmente. |
|
|
Das Innere des Kopfes bekommen wir in einem Längsschnitt zu Gesicht, wenn wir ihn mit einer Rasierklinge spalten . |
|
|
Wir legen den Kopf in eine Rinne im Paraffin, trennen die Antennen an ihrer Basis und das Labium etwa mit zwei Dritteln seiner Länge ab. Die Komplexaugen kappen wir mit der Rasierklinge und schneiden von dorsal kommend den Kopf sagittal durch. Die beiden Hälften betrachten wir kurz, um festzustellen, wie gut wir die Sagittalebene getroffen haben. Im allgemeinen genügt es, in einer Hälfte einige Muskelfasern der mächtigen Cibarialpumpe mittels der Insektennadel mit Häkchen zu entfernen, um den medianen Sinus der Aorta und den Nervus procurrens zu sehen. Wir übertragen beide Hälften des Kopfes auf einen Objektträger, wenn aus wässerigem Milieu kommend in einen Tropfen Glyzerin-Alkohol, wenn aus Glyzerin-Alkohol, dann in reines Glyzerin. Das Stück mit dem Frontalnerven positionieren wir zur Innenansicht, das andere zur Außenansicht und legen ein Deckglas auf. Damit es nicht kippt, unterlegen wir mit Glasstückchen oder den abgetrennten Beinen der Raubwanze. |
|
|
Unter der binokularen Lupe oder dem Mikroskop (Abb. 5 a) fallen bei zehnfacher Vergrößerung zuerst die zahlreichen, dorsoventral verlaufenden Muskelfasern der Cibarialpumpe auf. Im Bereich des Hinterhauptes finden sich das zum Gehirn vereinigte Cerebral- und Unterschlundganglion, durchzogen vom sklerotisierten Pharynx. Vor dessen Austritt durch das Hinterhauptsloch findet sich eine Hinterpharynxpumpe, erkennbar an einigen Muskelfasern, die dorsad und ventrad von ihm abgehen. Unmittelbar vor dem Gehirn liegt das kugelige Frontalganglion; es markiert den Übergang des Cibarium in den Pharynx, den morphologischen Mund. Auch den nach vorn zu den Cibarialdilatoren abgehenden Nervus procurrens sehen wir deutlicher, ebenso die Wurzel des Nervus recurrens. Er zieht caudad zusammen mit der Aorta dorsad des Pharynx zu den Corpora cardiaca und Corpora allata. Diese hätte man nahe des Hinterhauptsloches zu suchen. Wegen ihrer Kleinheit kann man sie nur in gefärbten Schnitten sehen. Parallel zum Nervus procurrens verläuft jederseits hinter der Sagittalebene eine Trachee, die ventrad des Unterschlundganglion vom Hinterhauptsloch herkommt. Dorsad des N. procurrens erweitert sich die Aorta zum oben erwähnten, breiten Sinus. Im vorderen Bereich des Kopfes endet das Cibarium zwischen den Stechborsten, was wir nicht genau erkennen können. Wir sehen die vorderen Tentorialgruben, Einstülpungen der longitudinalen Tentorialarme; deren weiterer Verlauf bis an das Cranium ist nicht sicher feststellbar. In der Außenansicht sehen wir abgesehen vom Ocellus und der Öffnung für das Komplexauge den Sockel, auf dem die Antenne eingelenkt ist. Dort befinden sich auch die basalen Antennenmuskeln. An der vorderen Spitze des Kopfes deckt das zweigliedrige Labrum die darunter liegende große Biegung der Stechborsten, umschlossen von der Basis des Labium. |
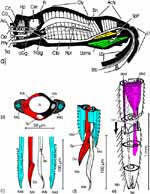  Abb. 5 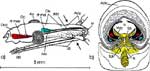 Abb 6 |
|
Die zuvor abgetrennten, distalen zwei Drittel des Labium legen wir auf einen Objektträger in einen Tropfen Glyzerin. Mit zwei Nadeln spreizen wir das Labium und ziehen die Stechborsten heraus (wobei die medianen Maxillen (Mx) vereinigt bleiben können) und legen ein Deckglas auf (Abb. 5 c-e). Wir betrachten die gezähnelten Spitzen der Mandibel. Die Länge der Zahnreihe entspricht der Strecke, um die die Mandibel beim Stechen hin und her bewegt werden können. Um sie möglichst genau zu messen, markieren wir die Strecke mit dem Zeichenapparat. Dann projizieren und markieren wir bei gleicher Vergrößerung die Teilung des Objektmikrometers parallel dazu und lesen etwa 90 μm Länge ab. |
|
|
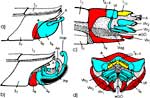
Die beiden Maxillen bilden gemeinsam den Nahrungs- und den Speichelkanal. Die rechte Maxille endet als lange, spitze Geißel, während die linke einen spitz zulaufenden, hohlen Dorn bildet. Dieser kann bis zu rechtwinkelig abgespreizt werden. Dazu verhaken sich die beiden Maxillen an der Basis des Dorns und verschieben sich dann gegeneinander (Abb. 7f). Die Verfalzung der beiden Maxillen und die Lumina von Nahrungs- und Speichelrohr können in Querschnitten z.B. mit der Rasierklinge, am besten durch die Basis der Proboscis beobachtet werden (Abb. 5 b). Ein Querschnitt im Bereich der Antennensockel (Abb. 6 a) trifft die Speichelpumpe. Ihre dorsale Wand geht in das zungenförmige Ende des Hypopharynx über. Es ragt in den Nahrungskanal hinein und führt dabei zwei übereinander liegende, parallel verlaufende Ausführkanäle nach vorne. Der dorsale Ausführgang leitet den Speichel in den Kanal der vereinigten Maxillen. Ein zweiter größerer ventraler Ausführgang (Abb. 6 b) leitet Speichel zunächst in einen Speichelbeutel und von dort in den Tubus des Labium, der das Stechborstenbündel birgt und distal durch den Deckel (Abb. 5f) in der Ruhelage verschlossen wird (Wenk et al. 2009; 2010) (Abb. 6 b) (Sal). Das zweigliedrige Labium schließt die Stechborsten ein und trägt die beiden eng miteinander verbundenen Labellen. Deren terminale Schrillkante (Abb. 5 e, SKt) wird bei Erregung auf dem Rillenfeld zwischen den Coxen des 1. Beinpaares gerieben. |
|
|
Hält man eine Raubwanze in Rückenlage mit einer Pinzette fest, so lassen sich die heftigen Nickbewegungen des Kopfes und die zum Schrillen leicht nach rückwärts eingeschlagenen Labellen (bei D. maxima besonders) gut beobachten. Es handelt sich vermutlich um Schrecklaute; ein Gehörorgan ist nicht bekannt. |
|
|
Bei Triatoma infestans sind die Labellen pelzartig dicht mit Haaren besetzt. Ein schmales Rillenfeld ist vorhanden, eine entsprechende Bewegung beim Festhalten wenig ausgeprägt. Statt dessen speicheln die Wanzen ausgiebig: Möglicherweise dient hier das Rillenfeld zum Putzen der Stechborsten (Fig. 5). |
|
|
Für eine Präparation der basalen Muskulatur der Stechborsten müssen wir einen intakten Kopf zur besseren Fixierung am besten zusammen mit dem Prothorax aus Glyzerin-Alkohol ohne vorherige Entwässerung in Paraffin einschmelzen. Man macht mit dem Skalpell eine Grube in das Wachs des Präparierschälchens. Das zu präparierende Teil wird auf einem Filterpapier kurz abgelegt, um außen anhaftende Flüssigkeit zu entfernen. Danach plaziert man es in der gewünschten Position und schließt die Grube mit Splittern von Wachs, die mit einem erhitzten Draht geschmolzen werden. Danach überschichtet man mit Flüssigkeit und kann sofort beginnen zu präparieren. |
|
|
Dem in Seitenlage eingebetteten Kopf entfernen wir die uns zugewandte Seite und stoßen auf die basalen Teile der Stechborsten mit ihrer Muskulatur. Ansatz und Ursprung der Retraktoren sind jedoch nur in erster Orientierung zu erkennen. Für eine funktionell schlüssige Darstellung benötigen wir Serienschnitte wasserfrei in Paraffin mit Bienenwachs eingebetteter Köpfe in verschiedenen Richtungen. Dies kann hier nicht beschrieben werden. |
|
|
Ein Querschnitt durch den vorderen Abschnitt des Kopfes mit untergeschlagener Proboscis lässt sich auch mit der Rasierklinge herstellen. Man legt einen Kopf, Proboscis nach oben, mit wenig anhaftender Flüssigkeit auf einen Objektträger und gießt etwa aus einem soeben gelöschten Teelicht flüssiges Paraffin darauf. Nachdem sich die Oberfläche geschlossen hat, kühlt man mit kaltem Wasser. Danach löst man das Paraffinstück mit dem Skalpell ab, schneidet das Objekt keilförmig zu und stellt Freihand mit der Rasierklinge unter der binokularen Lupe Querschnitte her. Diese plaziert man jeweils auf einzelnen Objektträgern, entfernt mit der Nadel anhaftendes Paraffin und deckt in Glyzerin ein. Will man mehrere Schnitte in Serie anordnen, muss zuvor Eiweißglyzerin aufgebracht und dann sollten die möglichst trockenen Schnitte durch leichtes Anwärmen angeklebt werden. Man untersucht mit dem Mikroskop bei beliebiger Vergrößerung einschließlich Ölimmersion. |
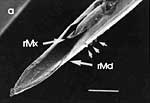 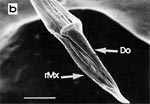 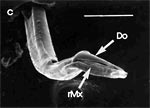 Abb. 7 a, b, c 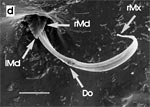 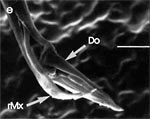 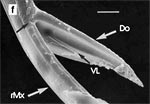 Abb. 7 d, e, f 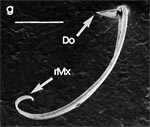 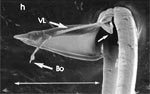 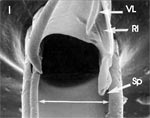 Abb. 7 g, h, i 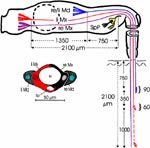 Abb 8 |
|
Wir orientieren uns am Cibarium mit seinen Dilatoren, dazwischen median der N. procurrens. Ventrad liegen die paarigen Ductus salivarii, laterad jederseits eine Maxille, erkennbar an der Speichelrinne, und eine röhrenförmige Mandibel zwischen den zugehörigen Retractoren. Die Querschnitte der vier Hauptstränge der Tracheen, zwei ventrale und je ein lateraler, sind optisch leer. |
|
|
Mit Hilfe des Zeichenapparates ermitteln wir den Durchmesser des Nahrungskanals (N) zu 38,6 μm, den des Speichelkanals (Sp) zu 4,8 μm. Verschobene Teile arrangieren wir zeichnerisch (Abb. 6 b). Färbt man zuvor am Stück, etwa mit Fuchsin, so lässt sich auch der Skelet-Muskelapparat näher untersuchen. |
|
| Stechvorgang bei Rhodnius prolixus: |
|
|
Von Raubwanzen, die unter mikroskopischer Beobachtung an Meerschweinchen und Ratten saugten und die auch kinematographisch registriert wurden (Lavoipierre, Dickerson and Gordon 1959), sowie durch rasterelektronenoptische Untersuchungen beim Füttern von Raubwanzen durch künstliche Membranen (Wirtz 1987) kennt man den Vorgang beim Stechen und Blutsaugen von Rhodnius prolixus ziemlich genau. |
|
|
Beim Einstechen in die Haut stoßen zuerst die Mandibel alternativ in die obersten Hautschichten vor und verankern sich dort, wobei sie, nach den anatomischen Gegebenheiten im Kopf der Raubwanzen zu urteilen (s. u.), maximal 0,7 mm Tiefe erreichen können. Die beiden flexiblen Maxillen zwischen ihnen können ebenfalls nach diesen Kriterien jedoch über 2 mm vordringen. Die Maxillen suchen mit peitschenartig raschen Bewegungen allseits nach einem ausreichend weiten Blutgefäß. Dabei biegt das Stechborstenbündel in der Führungsrinne des außen verbleibenden Labium mitunter kurzfristig aus. Nach probeweisem Saugen entstehen kleinere Hämatome, aus denen aber kein Blut aufgenommen wird. Sticht die Wanze zufällig ein zusagend weites Gefäß an, schiebt sich die rechte Maxille um die mehrfache Länge des knapp 100 µm langen Flagellum an seiner Spitze hinein. Die linke Maxille bleibt mit ihrem zungenförmigen, 60 µm langen Dorn an der Penetrationsstelle in der Gefäßwand zurück. Dabei wird der Dorn entweder außen an der Gefäßwand oder wahrscheinlicher an ihrer Innenseite um bis zu 90º abgespreizt. Erst jetzt strömt Blut durch den Nahrungskanal und der Magen der Wanze füllt sich. Das angestochene Blutgefäß kollabiert rhythmisch, offenbar durch den starken Sog der Cibarialpumpe. |
|
|
Rasterelektronenoptisch erkennt man an der Basis des Dorns einen Gelenkkopf, der in eine Pfanne auf dem dorsalen Rand der rechten Maxille einrastet. (Abb. 7 h). Werden beide Maxillen geringfügig gegeneinander verschoben, bewegt sich der Dorn. Die peitschenartigen Suchbewegungen der Maxillen müssen ebenfalls bei eingerastetem Dorn, aber mit etwas stärkeren Verschiebungen erzeugt werden. Für das Vorstrecken der rechten Maxille in ein Blutgefäß muss das Gelenk ausrasten. Möglicherweise befinden sich auf der rechten Maxille mehrere Pfannen für verschiedene Stellungen der linken Maxille. Außerdem trägt der Dorn noch eine Borste (Abb. 7 h, Bo), die aufgerichtet werden kann und das Einklappen der Geißel der rechten Maxille bewirken könnte (Abb. 7 b, c). Der Speichelkanal mündet an der ventralen Basis des Dorns als eingefalteter Trichter, der offenbar von der linken Maxille allein gebildet wird. Eine Leiste lenkt möglicherweise den Fluss des Speichels weiter bis zur Spitze des Dorns. Von dort kann er entweder in das umgebende Gewebe fließen, wenn der Dorn außerhalb der Gefäßwand liegt (lokale Betäubung?). Liegt er innerhalb, mischt sich der Speichel an der Basis des Dorns mit dem aufgenommenen Blut (Gerinnungshemmung?). Raubwanzen sind ausschließlich Kapillarsauger. Die funktionelle Mundöffnung liegt zwischen den Maxillen an der Basis des trichterförmigen Dorns. Der morphologische Mund liegt hinter dem Cibarium ventrad des Frontalganglions (Abb. 5a). |
|
|
Ermitteln der Einstichtiefe. Vollständig zurückgezogen kommen die Basen der Mandibel im vorderen Drittel der Länge des Kopfes, 750 μm hinter der Speichelpumpe zu liegen. Die Basen der Maxillen werden in der Ruhe beiderseits bis hinter die rückwärtige Begrenzung der Komplexaugen, nämlich um 1350 μm weiter zurückgezogen. Demnach können die Maxillen um diese Distanz weiter als die Mandibel, d.h. insgesamt 2100 μm vorgestoßen werden. Die Retraktoren der Maxillen entspringen am Hinterrand des Kopfes, dem Occiput. Da sie vermutlich nicht einfach um 2100 μm (mehr als das Doppelte ihrer Länge) gedehnt werden können, bedarf es weiterer Erklärungen für den Ablauf des Stechvorganges. Ähnliches gilt für die Protraktion der Mandibel um 750 μm. Die Basen der Maxillen werden tatsächlich bis an die Speichelpumpe vorgestoßen: Die jeweiligen Hälften des Speichelkanals beginnen nämlich unmittelbar an der Basis. Die angegebenen Distanzen lassen sich mit Hilfe von Rasierklingenschnitten, parasagittal und quer geführt, feststellen und mit dem Zeichenapparat ausmessen (Abb. 8). |
|
|
Das Labium und die Labellen bleiben während des Blutsaugens gerade gestreckt. Die Führungsrinne für das Stechborstenbündel ist stark sklerotisiert und erlaubt kein Ausweichen nach der Seite oder rückwärts, allenfalls nach vorne, was gelegentlich vorkommt (s.o.). Die Labellen werden auf ihrer Rückseite durch eine ovale Kerbe an ihrer Spitze nur 135 μm tief gespalten, können sich demnach praktisch nicht spreizen. Eine Membran (Abb. 5c, Mb) reicht von der Kerbe inwendig 65 μm weiter nach proximal. Sie senkt sich beim Stechen distalwärts, verdeckt so die Kerbe und dichtet die Einstichstelle ab. Der kräftige mediane Adductor funktioniert als Kompressor der Labellen. Er verschließt deren distale Backen und presst das Stechborstenbündel an der Einstichstelle verstärkt zusammen. Die paarigen Abduktoren, Antagonisten des Kompressors, lockern diese Umklammerung lediglich: Condylus und Ansatz der Sehne des Gelenkes der Labellen liegen nahe beisammen. Offensichtlich werden die Kräfte zum Penetrieren der Haut des Wirtes nach dem Prinzip des Stoßkabels entwickelt. Die einzelnen Positionen der beiden verschieden gestalteten Spitzen der Maxillen entsprechen den wechselnden Anforderungen während des Blutsaugens. Sie werden nach Art endoskopischer Werkzeuge zur minimal invasiven Chirurgie ausschließlich mit den Muskeln im cranialen Teil des Kopfes erzeugt. |
|
|
Personen, die noch keinerlei Erfahrung mit Raubwanzen hatten, spürten keinen Schmerz, weder während des Einstechens und Saugens, noch nach dem Stich. Exponierte man sie Raubwanzen mehrfach über mehrere Monate verteilt, so entwickelte sich eine Überempfindlichkeit vom verzögerten Typ. Eine Sofortreaktion blieb auch dann aus (Lavoipierre, Dickerson and Gordon, 1959). Die winzigen ersten Larvenstadien beginnen sofort zu saugen, wenn sie etwa beim Umsetzen in ein neues Käfig auf die Haut gelangen. Über Systematik, Biologie und Bekämpfung der Triatominen findet man eine kurze Übersicht bei Schofield (2000). |
|
| Literatur Wenk P, Lucic S, Betz O (2009) Funktionelle Anatomie des Hypopharynx und der Speichelpumpe beim Saugapparat der Raubwanze Rhodnius prolixus (Stål 1858) Heteroptera: Reduviidae). Mitt. Dtsch. Ges. Allg. Angew. Ent. 17: 281-284. Wenk P, Lucic S, Betz O (2010) Functional anatomy of the hypopharynx and the salivary pump in the feeding apparatus of the assassin bug Rhodnius prolixus (Stål 1858) (Heteroptera: Reduviidae). Zoomorph. 129:225-234. DOI 10.1007/s00435-010-0115-7 Schofield CJ (2000) Biosystematics and evolution of the Triatominae. Cad Saúda Pública, Rio de Janeiro. 16 (Sup.2): 89-92 |
 |