 |
2.1 Malaria und Culiciden |
|
Abb. 2.1
In der Epidermis abgegebene Sporozoiten werden von dendritischen Zellen (Dc) phagozytiert und mit dem subkutanen Lymphstrom (Sk) im regionalen Lymphknoten (Ln) deponiert. Dort verbleiben sie bis zum natürlichen Ende der Infektion (Chakravarty et al. 2007). Bei Kompatibilität von Infektiosität des Parasiten Plasmodium spec. und Empfänglichkeit des Wirtes wird die immunologische Reaktionslage umgestellt und generalisiert: Konditionierung des Immunapparates. Andere Sporozoiten erreichen beim Blutsaugen aus einer Kapillare oder einenperikapillären Blutpool (Po) über Kupfferzellen (Kc, Hz Hämozoin) und den Dissé Raum (D) die Leber und passieren einige Parenchymzellen ohne diese zu zerstören (Guilbride et al. 2012): Bestätigung der erfolgreichen Konditionierung durch eine somatische Migration. Nun erfolgt die limitierte erste Merogonie (Mer 1) in einer Parenchymzelle oder bei P. vivax die Bildung eines Hynozoiten (Hy). Nach der zweiten Merogonie (Mer 2) im zirkulierenden Blut (Tro Trophozoiten, Hz Hämozoin) entsteht das Quasisoma, das alsbald geschlechtlich differenzierte Gamonten (Gam, Gametozyten) mit verlängerter Lebenserwartung hervorbringt. Chakravarty et al. 2007 CD8+ T-lymphocytes protective against malaria liver stages are primed in skin draining lymph nodes. Nat. Med. 13 (3),1035-1041. Guilbride et al. 2012. Malaria’s deadly secret: a skin stage. Trends. Paras. 28: 142-150
|
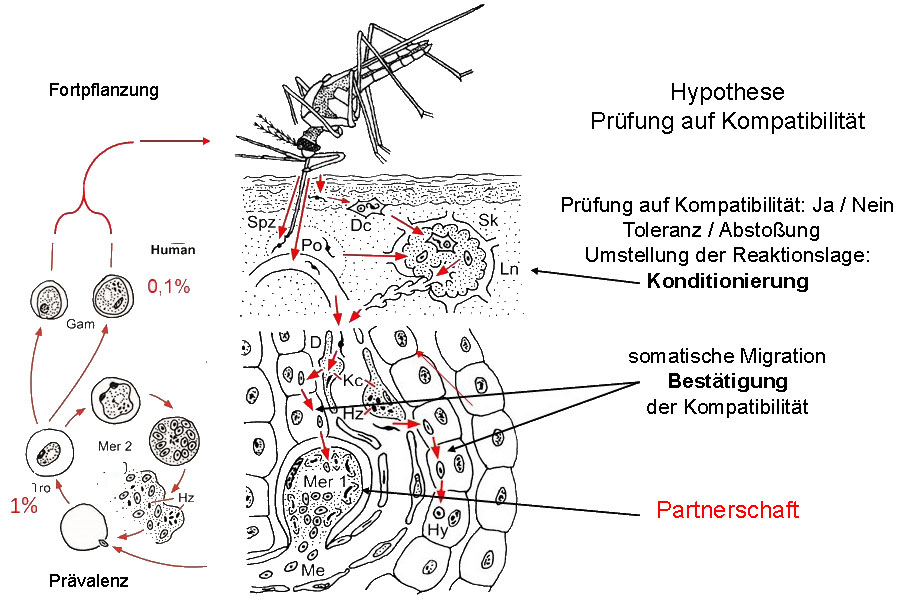 Abb.2.1 |
|
Figure 2.1 The first sporozoites (Spz) transferred by the mosquito bite to the superficial layers of the epidermis are phagocytosed by dendritic cells (Dc) and transported via the subcutis to the regional lymph node (Ln) in which they are deposited (initial tissue contact). They survive there until the infection ends spontaneously. In cases of positive compatibility, the reaction type of the immune response is converted to tolerance (conditioning). Approximately one third of the total volume of the circulating blood passes through the liver every 80 seconds. The converted reaction type of the immune response to tolerance will thereby be generalised. Some Dc with living sporozoites might be distributed further from the regional lymph node via efferent lymphatic vessels. Sporozoites mixed with the circulating blood by mosquito saliva at the biting spot immediately pass into a capillary or, during pool feeding, also to the liver. Sporozoites pass through Kupffer cells (Kc) and the Dissée space (D) and then enter a parenchymatomous cell. In cases in which sporozoites move further through a few additional parenchymatomous cells but without damaging them, compatibility is confirmed and the first merogonia (Mer 1) or hypnozoites (Hy) are formed. The foregoing short somatic migration opens up the specific partnership. Now, it follows the first stage of the life cycle via genetically limited multiplication to a prevalence of 1% and propagation to 0.1% in the circulating blood. Proof of compatibility must be repeated, even for additional initial contacts. This simple aspect has received no experimental attention or has been overlooked, since the specific partners will have previously been selected. However, compatibility is a rare event in free nature. Human populations sharing habitats with chimpanzees will also be contacted their own tolerated Plasmodium species. However, these species do not induce protecting immunity against human-pathogenic species (see text).
|
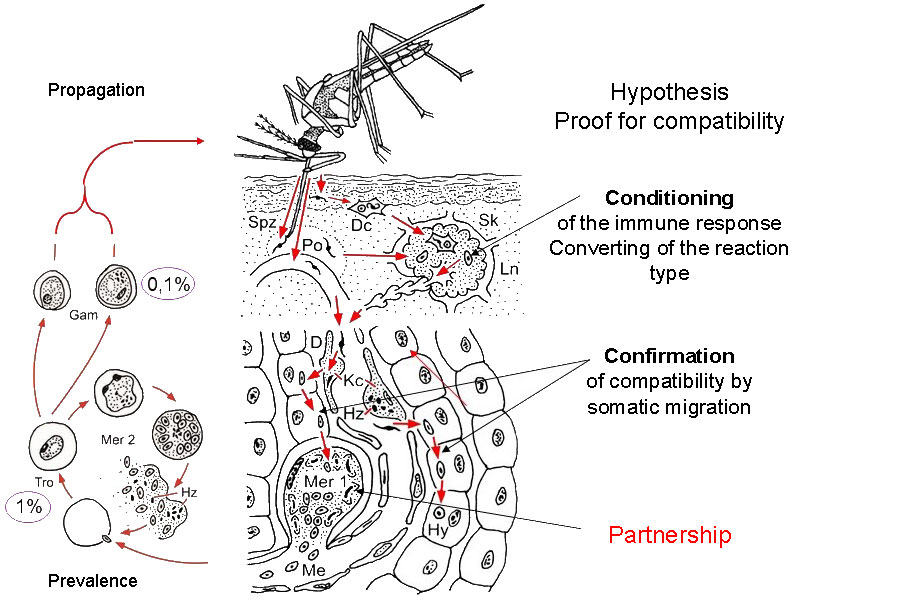 Fig. 2.1 |
| Abb. 2.1.1 Quantitativer Entwicklungszyklus von Plasmodium falciparum |
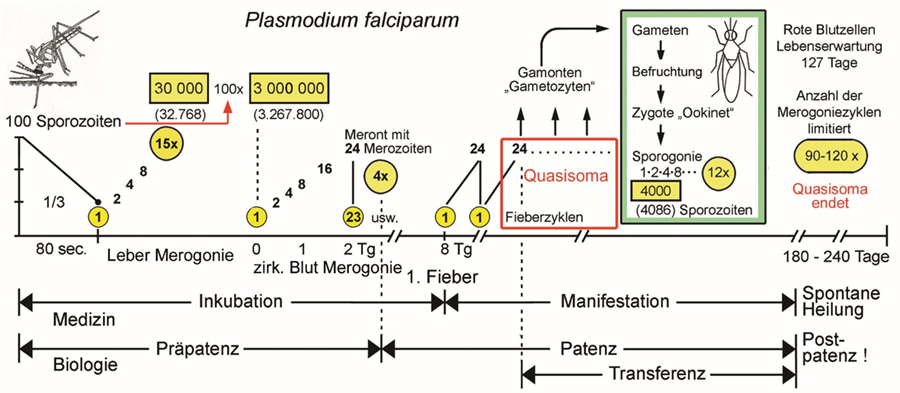 Abb. 2.1.1 |
|
Abb. 2.1.1b Die Anzahl Meronten pro Zyste in der Leber, die von den vier humanpathogenen Plasmodien erreicht werden, entsprechen annähernd 13, 14 oder 15 Zweiteilungen. Dieses Limit ist offenbar genetisch determiniert. Die Anzahl Fieberschübe, die klinisch beobachtet werden, wenn die initiale Phase überlebt wurde und die Infektion in die chronische Phase übergegangen ist, entspricht der Lebenserwartung des Quasisoma. Weitere Fieberschübe beruhen auf neuerlichen Infektionen. In endemischen Regionen mit hoher Übertragungsrate ist mit Superinfektionen bei unterschwelliger Symptomatik zu rechnen. Diese erworbene scheinbare Resistenz wird als Semi-Immunität bezeichnet. Verlässt man ein endemisches Gebiet nach längerem oder mehrfachem Aufenthalt oder in dem man aufgewachsen ist, hält die Semi-Immunität maximal fünf Jahre an. Kehrt man danach zurück, so wird eine neuerliche Infektion mit allen Risiken wieder manifest. Abwechselnde Regen- und Trockenzeiten, bzw. Übertragungsraten können einen Shift zwischen Manifestation und Semi-Immunität erzeugen, der sich im Verbund von Empfänglichkeit, Gamontenbildung und klinischer Symptomatik auswirkt (s. Abb. 2.1.2). Die einzelnen Arten der humanpathogenen Plasmodien beeinflussen einander im artspezifischen Shiften nicht. Bei der ersten Manifestation hat P. falciparum offenbar Priorität, d.h. die anderen Arten werden erst sekundär manifest. Gelingt es die Kindersterblichkeit durch vorbeugende Maßnahmen entscheidend zu verringern, so verschiebt sich der Shift in höhere Altersklassen. Dies wurde bei endemischer Malaria in Afrika nördlich der Sahara bereits berichtet.
|
 Abb. 2.1.1b |
|
Abb. 2.1.1c Die Amplitude der Fortpflanzung begrenzt den für eine Selektion notwendigen Überschuss durch die Kontrolle der Dichte der Gamonten. Sie kann in der Regenzeit auf ein Vielfaches der relativ geringeren Dichte in der Trockenzeit ansteigen. Zugleich nimmt die Prävalenz, d.h. die Empfänglichkeit für die seltenen Infektionen in der Trockenzeit zu. Die Trophozoiten verändern indessen ihre Dichte saisonal nicht. Dieser Effekt nimmt mit dem Lebensalter des Menschen, d.h. Zeit des Aufenthalts in der endemischen Region zu (s. Buch Abb. 2.1.1, S 31). Prävalenz und Dichte der Gamonten ist in den jüngsten Altersklassen am höchsten. Sie sind zahlenmäßig am größten, sodass wenige Fälle für den Erhalt der Endemie ausreichen. Eine geringe Amplitude hält großen Abstand zu den Fatalitätsgrenzen.
|
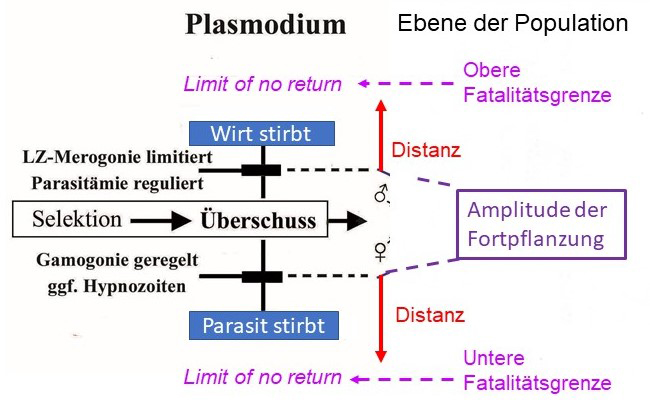 Abb. 2.1.1c |
|
Abb. 2.1.1d Die beim Blutsaugen in den Mitteldarm der Mücke aufgenommenen sexuell differenten Gamonten vereinigen sich unter bestimmten physiko-chemischen Bedingungen zu einem kleinen Teil zu kurzzeitig diploiden Ookineten. Diese können die peritrophe Membran nur passieren, wenn sie zufällig dicht anliegen und die Membran noch nicht verhärtet ist. In der basalen Plasmazone der zunächst gelegenen Mitteldarmzelle erfolgt die Sporogenie durch die genetisch determinierte Anzahl Teilungen in der Oozyste. Die ausschwärmenden Sporozoiten mobilisieren das Intern Defence System der Mücke, dessen Makrophagen die meisten Sporozoiten während der Passage durch die Hämolymphe abfangen. Die übrigbleibenden Sporozoiten sammeln sich in den durch Riesenchromosomen polyploiden Drüsenzellen einzelner Loben der Speicheldrüse an. Diese Entwicklung dauert je nach Temperatur am Ruheplatz der Mücke etwa eine Woche. In dieser Zeit verläuft die Oogenese und Eiablage der Mücke. Danach saugt sie erneut Blut, sodass die Sporozoiten erst beim dritten Blutsaugen übertragen werden. Auch unter optimalen Zuchtbedingungen erhält man 20 bis 40%, im besten Fall nach Jahren der Haltung eines Mückenstammes 80 % infektionstüchtige Mücken. Die zweite Blutmalzeit begünstigt das Überleben der Mücke. Das zweite Blutsaugen kann auch an einem Nutz- oder Wildtier stattfinden. Infolgedessen ist der gesamte potentielle Genpool des Vektors an der Evolution seiner Spezifität beteiligt, wobei dies auch für andere Parasiten gilt. Häufig findet man neben Plasmodien auch Stadien von anderen Organismen. Die Eignung der Gattung Anopheles für die Entwicklung von Plasmodien der Säugetiere und andererseits von Culex für Plasmodien der Vögel ist angesichts der Ausschließlichkeit offenbar genetisch bedingt. Die begrenzte Erfolgsrate einzelner Arten als ein teilweises Versagen der Abwehr durch das Intern Defence System zu erklären, das man nur wenig verbessern müsste, läuft darauf hinaus „to improve nature.“ Eine Gasse mit vielen verschiedenen Bedingungen, ist ein Hindernislauf, der die Artspezifität des Vektors im jeweiligen Ökosystem begründet. Stechmücken müssen als Invertebraten die ursprünglichen Wirte gewesen sein. Sobald das Überleben der Partnerschaft einmal gewährleistet war, verschwand der Selektionsdruck zur Verbesserung. Das Blutsaugen an warmblütigen Wirbeltieren mit Immunreaktion, verbunden mit Pathogenität, Allergie und Letalität führte zur Kontrolle der Bevölkerungsdichte (s. Abb. 2.1.5). Auch die generelle Koppelung einer stattgehabten Infektion mit einer Allergie gleicher Spezifität ist keine Entgleisung der fraglichen Immunreaktion. Die Koppelung ist nicht nur diagnostisch verwertbar, sondern gehört zur Revierverteidigung des Wirtes. Es begrenzt auch das Risiko, dass Arten mit selektiv entwickelten extrem vorteiligen Eigenschaften bei Änderung ihrer allgemeinen Lebensbedingungen ihre Ressourcen erschöpfen und aussterben (s. Abb. 2.1.6). Es versteht sich, dass sich in unseren Stammbäumen nur Lebewesen finden, die im Freileben spezifisch empfänglich für mehrere Parasiten sind. Kurz gesagt: Jedes freilebende Lebewesen hat irgendwelche Parasiten, wenn nicht, ist es krank. Malaria ist mit Abstand die am intensivsten erforschte Infektionskrankheit. An ihr lassen sich alle Grundregeln der parasitischen Partnerschaft aufzeigen. Literatur Scheuermayer
|
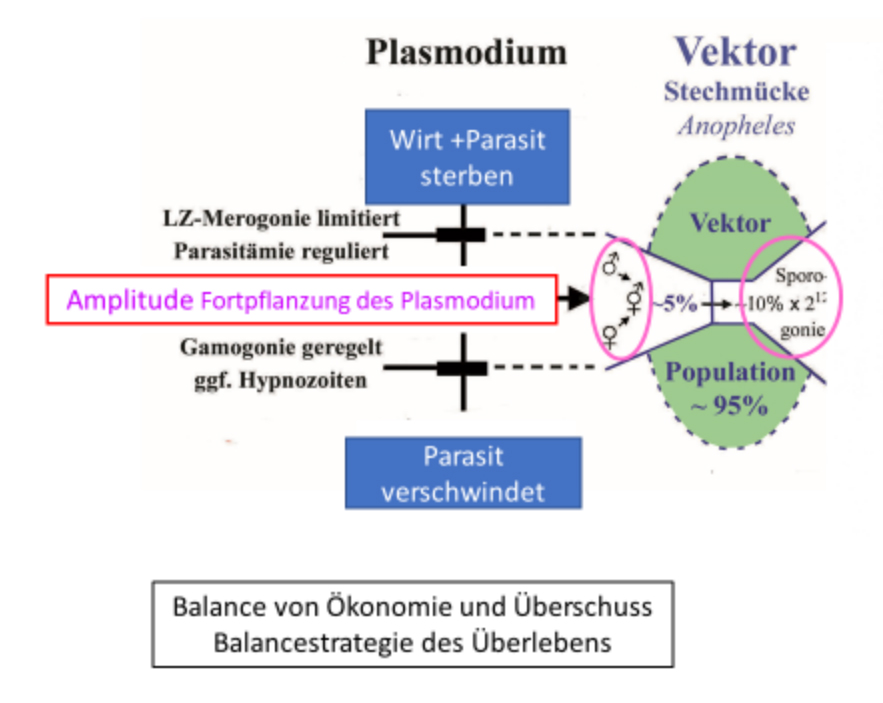 Abb. 2.1.1d |
|
|
|
|
Abb. 2.1.2 Empfänglichkeit, Gamontenbildung und klinische Symptome (Fieber ect.) werden im Verbund durch die Einzel- bzw. Mehrfachinfektion geregelt. Eine Semi-immunität hält ohne erneute Infektion zwei bis maximal fünf Jahre an.
|
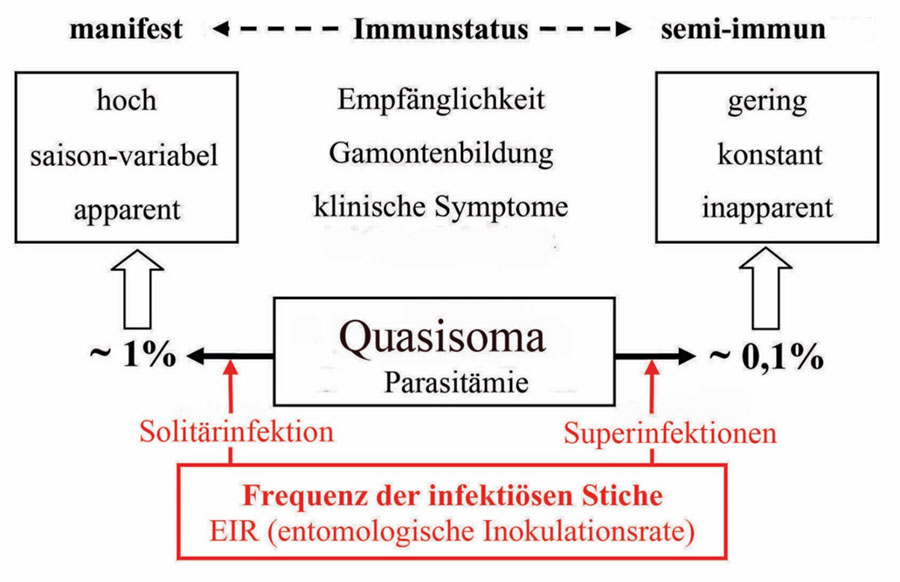 Abb. 2.1.2 |
|
Abb. 2.1.3
Hektogramm Vektorkapazität einer Anopheles Population und Basisreproduktionszahl der Malaria
|
 Abb. 2.1.3 |
|
Abb. 2.1.4 D Dissé-Raum, Dc dendritische Zelle, Ex Exflagellation, Gam Gamonten, Hy Hypnozoit, Hz Hämozoin, Kc Kupffer-Sternzelle, Ln Lymphknoten, Me Merozoit, Mer 1 erste Merogonie in Leberparenchymzelle, Mer 2 zweite Merogonie in roten Blutzellen, Ook Ookinet, PM peritrophe Membran, Po Mikrohämatom, R! Reduktionsteilung, Sg Speicheldrüse, Sk Subkutis, Spg Sporogonie, Spz Sporozoit, Tro Trophozoit Wenk und Renz (2012) Parasitism and evolution: opposing versus balancing strategies. Historical Biology 25 (2) 1-3.
|
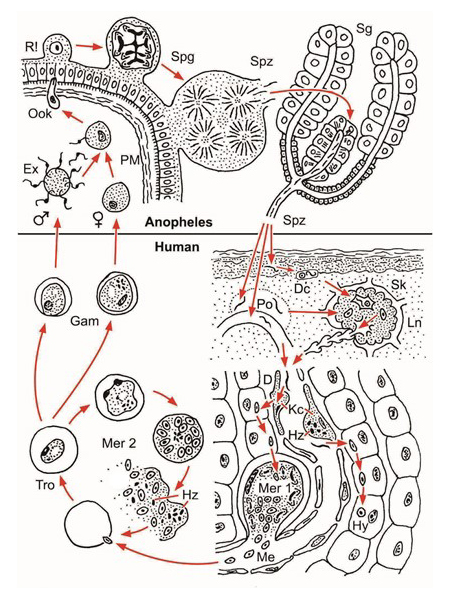 Abb. 2.1.4 |
|
Abb. 2.1.5
In einer Endemie sind Parasit und Wirt im Gleichgewicht, ggf vermittelt vom Vektor über dessen Kontaktrate. Bei Malaria muss der Überschuss in Vermehrung und Fortpflanzung des Plasmodiums durch die natürlichen Verluste die Reproduktionszahl R0 erreichen. Die Distanz zu den Fatalitätsgrenzen muss ausreichen, um die Variation der Symptomatik vielfacher Infektionen aufzufangen. Eine auf Angriff und Abwehr gegründete Partnerschaft ist für beide Teilnehmer destabilisierend und ökonomisch von Nachteil. In der Evolution käme es zum Wettrüsten (arms race) und bei Belastung zum Aussterben, denn der notwendige Überschuss in der Fortpflanzung erschöpfte die Ressourcen nutzlos. Trotzdem dient dieses widersprüchliche Prinzip allgemein als Grundlage, um die kausalen Mechanismen eines Parasitismus experimentell zu erforschen. Pathogene Effekte zu vermeiden verbessert zwar die Chancen individuell zu überleben. Die Evolution garantiert jedoch das Überleben von Populationen, die bei der Selektion notwendigerweise auch Verluste erleiden. Tatsächlich existiert in freier Natur kein Organismus ohne für eine Reihe von Parasiten empfänglich zu sein. Der Parasitismus ist polyphyletisch entstanden. Selbst Schlupfwespen haben Superparasiten und diese nochmals Parasiten. Trotz Pathogenität muss die parasitische Partnerschaft einen potentiellen Selektionsvorteil haben, der sich auf Populationsebene auswirkt. Er besteht in der Kontrolle der Populationsdichte des Wirtes und sekundär über die Kontaktrate auch die des Parasiten (Prävalenz). Dies schont die Ressourcen des Wirtes, stabilisiert das aktuelle Ökosystem und distanziert die Fatalitätsgrenzen (fatality limits of no return), d.h. das Risiko des Aussterbens des Wirtes (und damit auch des Parasiten), wenn sich dessen Lebensbedingungen dauerhaft erheblich ändern. Risiken mit geringem Aufwand zu vermindern, entspricht dem Prinzip der Versicherung. Als Metapher auf den Parasitismus lassen sich die Funktionen der beteiligten Faktoren gleichsetzen. Selbst Versicherungen rückversichern sich für extreme Situationen. Der Versicherungsfall wird nach seiner Häufigkeit bzw. Seltenheit eingeschätzt. Die Teilnahme ist fakultativ, muss aber der Häufigkeit angemessen sein. Argumentiert man naturwissenschaftlich, sollte ein wertfreier Begriff verwendet werden, um die Hypothesen für Voraussagen logisch einwandfrei, d.h. frei von Widersprüchen formulieren zu können. Anstelle von Parasitismus bietet sich der Terminus Parabiose an. Er würde eine besondere Form der Symbiose bezeichnen, die nur bei Parabionten (Begleitorganismen) auftritt.
|
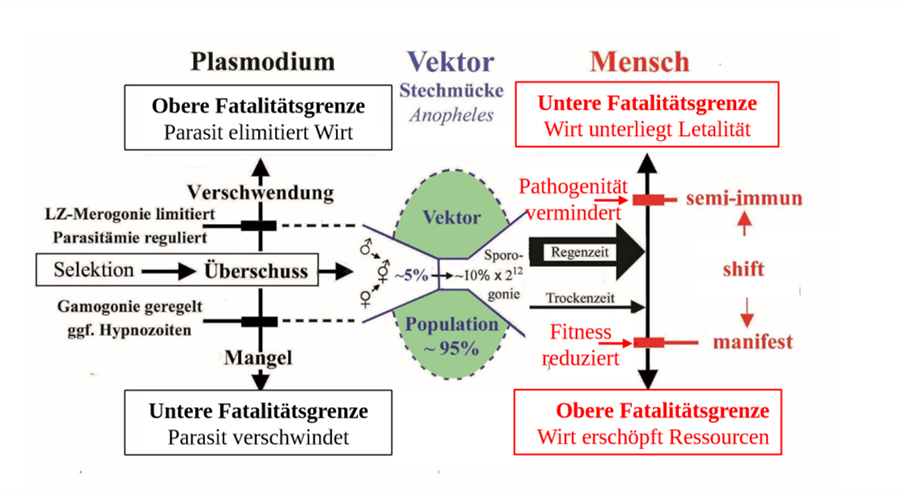 Abb. 2.1.5 |
|
Abb. 2.1.6 Jede Subspezies von Schimpansen hat besondere Plasmodien. Sie passen deren Besiedelungsdichte an ihre Lebensbedingungen, d.h. dem lokalen Ökosystem an. In der hauchdünnen Schleimschicht, dem Mucus, welcher die Kotmasse, den Chymus bedeckt, finden sich in Abklatschpräparaten ausgeschiedene rote Blutzellen mit Stadien von Plasmodien, die man bekannten oder neu zu benennenden Arten zuordnen kann. In der Untergattung Laverania ermittelte man anhand der Mitochondrien deren genetische Beziehungen. Plasmodium (syn. Laverania) praefalciparum, könnte z.B. nachrücken, wenn P. falciparum aus der menschlichen Bevölkerung derselben Region eliminiert würde (Rayner et al. 2011). In mehreren Regionen Westafrikas südlich der Sahara untersuchte man am Boden aufgefundene Kotdepositionen von Schimpansen, die als Unterarten geschlossene kleinere Regionen besiedelten. Jede der insgesamt sechs Subspezies von Schimpansen hatte eine charakteristische Sammlung von als kompatibel anzusehenden Plasmodienarten. Deren Prävalenz spiegelte die ökologisch austarierte Kontrolle der Populationsdichte der jeweiligen Unterart von Schimpansen. Man darf annehmen, dass ein Schimpanse aus einer anderen Region mit anders kompatiblen Plasmodien die örtlich vorgefundenen immunologisch nicht toleriert. Der verirrte oder vertriebene Schimpanse anderer Unterart überlebt ohnehin sozial allenfalls unter Stress. Schimpansen wandern als Großgruppen durch ihr angestammtes Revier. Dadurch konnten sich die Unterarten nicht nur im Verhalten charakterisieren, sondern auch immunologisch innerhalb einer klimatisch gleichen Region, dem eigenen Revier abgrenzen. Parasiten befördern die Evolution. Rayner JC, Liu W, Peeters M, Sharp PM, Hahn BH . 2011. A plethora of Plasmodium species in wild apes: a source of human infection? Trends Paras 27: 222-229.
|
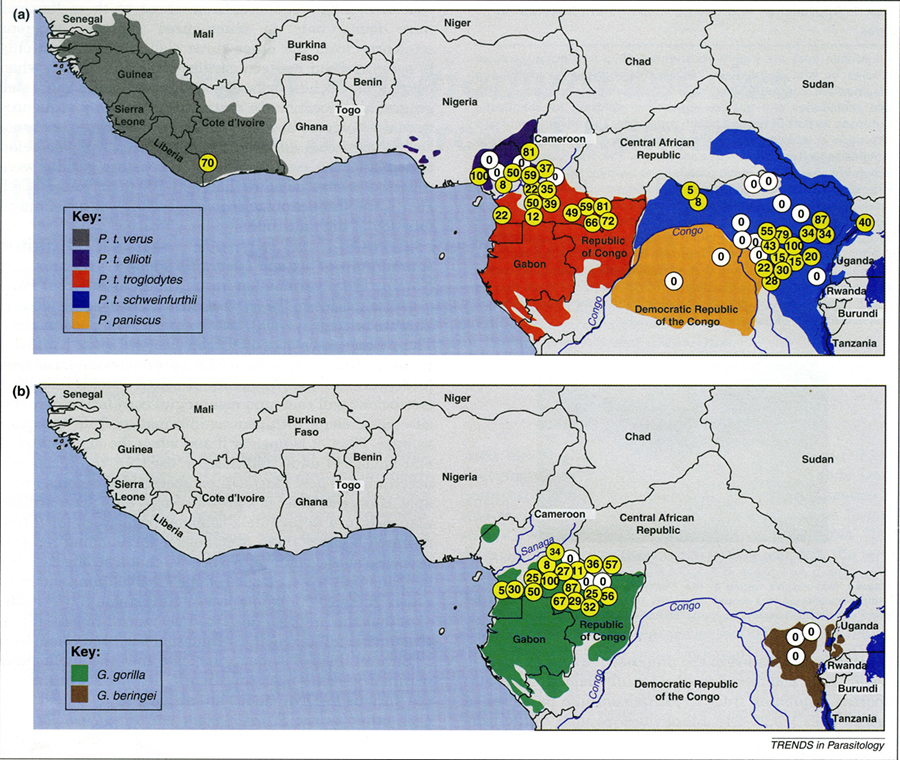 Abb. 2.1.6 |
|
Abb. 2.1.7 Einem Risiko vorzubeugen, könnte als zielgerichtete, d.h. teleologisch begründete Eigenschaft aufgefasst werden. In der Evolution werden jedoch lediglich solche Eigenschaften selektiv gefördert, die die Chance verbessern individuell zu überleben. "Nothing in biology makes sense except in the light of evolution" Dobzhanski 1973. Welchen selektiven Vorteil bringt einem Wirt seine spezifische Empfänglichkeit für einen bestimmten Parasiten? Parasitismus beruht auf zwei gegenläufigen Korrelationen: Eine gesteigerte Kontaktrate des Wirtes fördert die Fortpflanzung des Parasiten, zugleich mindert dessen Pathogenität das Überleben des Wirtes. In der energetischen Bilanz der Partnerschaft kontrolliert der Parasit die Populationsdichte seines Wirtes umso genauer, je spezifischer die Partnerschaft mit dem Wirt ist. Die erreichte Ökonomie ist ökologisch stabil. Der Begriff „Parasit“ ist einer sozialen Entgleisung entlehnt. Ein potenzieller Begleitorganismus sollte neutral als Parabiont und Parasitismus als Parabiose, das Fach als Parabiologie bezeichnet werden. „Schmarotzer“ verbietet sich von selbst. Biomedizin ist ein interdisziplinäres Fachgebiet. Die Biologie der Humanparasiten versucht medizinisch offene Fragen mit biologischen Lösungen zu beantworten. Die medizinische Parasitologie sollte zumindest biologischen Erkenntnissen nicht widersprechen. Die Hypothese von Angriff und Abwehr erklärt die Evolution von Parasitismus mit einem Wettrüsten. Es ist für beide Partner ruinös und destabilisiert ihre Populationen, zwei evolutive Nachteile. Die entscheidenden Vorteile einer biologischen Partnerschaft sind jedoch Ökonomie und Stabilität. Beide gilt es bei der Bekämpfung einer Parasitose des Menschen oder seiner Nutztiere bzw. -pflanzen zu ersetzen. Hunger, Korruption und Kriege machen jeden Erfolg zunichte. Eine schützende Impfung gegen eine Infektion mit einem lebenden Agens mobilisiert keinen zielgerichtet vorbereiteten Abwehrmechanismus. Sie verschafft dem Wirt lediglich einen Informationsvorsprung für eine Partnerschaft. Das Intervall der dafür notwendigen Erinnerung zwischen Prägung und Abruf der Information ist unbestimmt aber erheblich, bezogen auf die Lebenserwartung des Wirtes. Die Partnerschaft eines warmblütigen Wirtes mit einem potenziell pathogenen bakteriellen Agens „Parasit“ endet mit der Alternative Tod oder Immunität des Wirtes. In beiden Fällen ist für den Parasiten die aktuelle Partnerschaft mit dem Wirt zu ende. Der Ausdruck gegebenen Falles sei dann „der Ofen aus“ beschreibt die Situation trefflich: Brennt das Feuer nicht mehr, hilft kein Nachschieben von Brennmaterial. Das Agens überlebt nur durch Weitergabe seines Feuers, d.h. Parasiten pflanzen sich nur fort, wenn sie das aktuelle Wirtsindividuum wechseln. Die Strategien des Wirtswechsels bestimmen die Maßnahmen zur Bekämpfung des pathogenen Agens. Ökonomie und Stabilität der Population des Wirtes müssen dabei zumindest geschont werden. Eukaryotische, proto- und metazoische Parasiten mit im Vergleich zum Wirt erheblicher oder gar gleicher Lebenserwartung überleben die Partnerschaft durch Balance- besser Simultan-Strategie. Die Wirte tolerieren das Agens immunologisch bei dessen hingezogener (protrahierter) oder schwacher Pathogenität. Eine vorbeugend schützende Impfung ist trotz aller Anstrengungen bis heute auch in Ansätzen bei eukaryotischen Parasiten, d.h. Plasmodien, Trypanosomen, Schistosomen und Filarien, um nur die wichtigsten humanpathogenen zu nennen, nicht möglich. Die Sexualität der Eukaryoten beschleunigt auch gegenwärtig noch die Evolution überlebenswichtiger Eigenschaften, weil jede individuelle Fortpflanzung eine genetische Neukombination ist. Die lediglich multiple Vermehrung eines pathogenen Agens Parasit erhöht die Chance des Ereignisses Mutation. Fortpflanzung und Vermehrung sind bei Sarkosporidien, wie z.B. Toxoplasma gondii, auf verschiedene Wirte verteilt, ein Vorteil zyklischer (heteroxener ) anstelle von direkter (monoxener) Entwicklung von Parasiten (s. Abb. 1.3). Die simultane Partnerschaft stabilisiert die Populationsdichte des Wirts durch die genannten gegenläufigen Korrelationen bei einem ökonomisch tragbaren Maß. Ökonomisch bedeutet bei Lebewesen: Der verlustreiche Überschuss zur Fortpflanzung des Agens Parasit muss einerseits für eine wirkungsvolle Selektion ausreichen, darf aber andererseits durch seine Pathogenität seine Ressourcen nicht erschöpfen. Es entsteht ein „Korridor der Partnerschaft“, der zu beiden Fatalitätsgrenzen jedes Partners Abstand hält (s. Abb. 2.1.1c). Das Eingehen auf die Partnerschaft ist für den Wirt zwar fakultativ, bringt ihm jedoch den Vorteil der Ökonomie durch Kontrolle seiner Populationsdichte. Für den Parasiten ist die Partnerschaft obligatorisch, denn der Wirt ist seine garantierte aber einzige Ressource. Das erprobend bestätigte Überleben von förderlichen Mutanten ist für die Evolution von Parasiten unentbehrlich. Sie mindern das Risiko des Aussterbens ihrer Wirte bei der Kontrolle von deren Populationsdichte. Tatsächlich sind alle rezenten Lebewesen im natürlichen Freileben zumeist von verschiedenen Parasiten befallen. Selbst Parasiten haben Superparasiten. Die spekulativ erfassten Beziehungen der Partner bilden ein Netz, dessen Verknüpfungen bei grundsätzlichen Fragestellungen, z.B. des Übergangs einer Epidemie in eine Endemie, herangezogen werden müssen (s. Abb. 2.1.3 Hektogramm Vektorkapazität einer Anopheles Population und Basisreproduktionszahl der Malaria). Malaria ist mit Abstand die am meisten bearbeitete Infektion des Menschen überhaupt. Der ziemlich rasch ablaufende Lebenszyklus der Plasmodien begünstigt wissenschaftliche Erkenntnisse, die allgemein gültige Aussagen ermöglichen.
|
 Abb. 2.1.7 |
 |
zur Übersicht |